2010-02-24 |到了向全国人民公开转基因大米真相的时刻了——呼吁两会关注转基因大米的问题
北京大学免疫学系 王月丹 博士
王月丹,男,1972年12月出生,医学博士。现任北京大学医学部免疫学系副主任、北京大学医学部生物医学实验教学中心副主任兼病原与免疫学综合实验室主任。自1996年起,开始从事免疫学的研究工作。先后从事过血液肿瘤的生长因子及其信号调控、免疫细胞的功能活化及其相关信号传导、核辐射损伤与抗原提呈细胞损伤和胸腺细胞发育的研究等方面的研究工作,有关论文发表在《Oncogene》和《International Immunology》等专业杂志上。2002年8月开始,在北京大学医学部任教,从事免疫学的科研与教学工作。2003年1月至7月,在香港科技大学生物系进行SARS的抗原肽疫苗研制和SARS传播与环境因素的研究工作,首先报道了SARS感染后机体内存在针对SARS抗原肽的特异性细胞免疫应答,并通过表达重组SARS表面蛋白改良WESTERN BLOT法作为ELISA诊断SARS感染的补充,有关论文发表在《Journal of Virology》和《Clinical Immunology》等国内外专业杂志上,并得到美国NIH临床研究所学者的高度评价,有关的结果在第12届国际免疫学联盟学术大会上发表并发言。
近两年来,在肿瘤免疫和肿瘤抗原肽疫苗的研究方法取得了进展,建立了免疫信息学、结构化学计算、细胞生物学检测与免疫反应验证的抗原肽疫苗筛选体系,先后发现了多种癌-睾丸(C-T)抗原的功能性抗原肽序列,有关结果被《British Journal Of Cancer》等杂志发表。目前,正在主持《SARS相关冠状病毒抗原肽疫苗的基础研究》等多项各级项目7项,同时参加《髓质性胸腺细胞功能发育及诱导其发育的细胞与分子机理》等其它3项研究计划。到目前为止,共在国内外专业期刊上发表文章40余篇,其中SCI收录10余篇,同时申请专利4项,其中国际专利1项。
原文:http://immunohealth.blog.sohu.com/144813623.html
前一段时间,有很多的网站都在攻击我对转基因食品安全的担忧,我认为这是有关利益集团的行为,而不是科学的行为,所以我是不会在意,也不会害怕的。我用真名实姓就是为了能公开讨论问题,而不像那些懦弱的人匿名搞什么人身攻击。为了使我们的每一位公民都享有食品安全的保证,我希望有关部门,尤其是农业管理部门和国务院,应该开放大家讨论转基因作物安全的话题,而不要封锁消息,搞一言堂。
作为这次最令人担忧的转基因大米中的BT蛋白,很多人认为BT蛋白很安全,他们的理由是BT蛋白农药用了上百年,而且其原理只对昆虫致病,所以很安全。很多网站都这么介绍,“苏云金杆菌简称B.t.,是包括许多变种的一类产晶体孢芽杆菌。可用于防治直翅目、鞘翅目、双翅目、膜翅目,特别是鳞翅目的多种害虫。苏云金杆菌可产生两大类毒素:内毒素(即伴孢晶体)和外毒(α、β和γ外毒素)。伴孢晶体是主要的毒素。在昆虫的碱性中肠中,可使肠道在几分钟内麻痹,昆虫停止取食,并很快破坏肠道内膜,造成细菌的营养细胞易于侵袭和穿透肠道底膜进入血淋巴,最后昆虫因饥饿和败血症而死亡。”有人还进行了人体试验,“对18名志愿者每人每天吞服30亿活芽孢,连服5天,4~5周后检查,一切化验结果正常,无毒性反应。”
但其实呢?我国有关的食品管理部门早就知道苏云金杆菌对人体是有毒害的,决不是在18人试验中那么安全的!那个自称“打鬼”的匿名胆小鬼说,我的论文不能作为依据,好,那么看看国家官方杂志《食品科学》,早在2007年28卷第3期的357页就已经撰文,揭示出苏云金杆菌其实与人体的致病菌蜡样芽孢杆菌是一种菌,而后者被认为是可以引起致命性呕吐和肠胃炎的病原体,其产生的热稳定性毒素可以在30分钟内引起人体发生呕吐,并曾经导致一名17岁的瑞士男孩由于呕吐引起的肝衰竭和横纹肌溶解而死亡。目前的研究发现,以前的所谓蜡样芽孢杆菌中70%是苏云金杆菌,而且目前商业用的苏云金杆菌菌株(我们的农药菌株)含有呕吐毒素和肠毒素基因。所以,目前我国的很多农产品和畜牧产品都受到了这种农药菌的污染,有些人甚至说被污染的牛奶是特意添加了苏云金杆菌益生菌的,很多人因此腹泻,但都被归结为了乳糖不耐受症等疾病,从而掩盖了BT致病的事实。
所以,BT是否安全是一目了然的,所以欧美国家不在本国推广转基因主粮是有原因的,所以我们如果搞转基因小麦,美国一定会干涉我们的。有人说,BT危险不能说BT蛋白危险。我认为转BT蛋白基因更危险,原因很简单,我们即使用了再大剂量的BT农药,在吃米前,我们也要脱粒和淘米的,所以是有机会避免毒性的。但是,一旦转到了内部,我们怎么才能把它和米分开呢?其次,BT基因本身在大米细胞内表达的量,我想是很难控制均一的,一旦产生了高表达的毒株,我们怎么才能铲除它呢?再有就是,BT基因在大米细胞内是否会发生变异,产生有毒的毒素呢?是否每次种稻子之前,我们都要对每粒种子进行基因鉴定呢?那么这些费用将远远超过其增产带给我们的效益。当然,上面的这些问题,我都不是本行,我也不懂它们的危害和解决办法。但是,作为一名免疫学的研究人员,我认为我们最危险的是,目前的一切实验都只是单用BT蛋白做过敏实验,但是BT蛋白在植物体内如果结合了其他蛋白,就可能引起新的过敏问题。这就好像是青霉素,其本身不是抗原,也不会引起过敏,但是其杂质或体内的降解产物,能与人血浆蛋白结合,激发机体产生IgE型的抗体,引起致命的哮喘和休克。BT蛋白也有这种潜在的危险。
我不信仰任何宗教,也不是天然的保守主义者,我支持转基因,也进行转基因的研究,我只是提醒对于食品安全这种关系人民健康和后代幸福的事情,不要轻率和盲目。很多人嘲笑英国的一位科学家反转基因的实验有缺陷,那么现在转基因实验室做到安全性结论,却没有任何免疫学的证据或者证据不充分,也是很不科学的和没有价值的。
所以,我呼吁有关部门开放关于转基因大米安全性的讨论,尤其是希望两会的代表和管理部门的官员能关注这件事。
北京大学免疫学系 王月丹 博士
于学院路38号
附:《食品科学》的论文
点击下载: 蜡状芽孢杆菌(Bacillus cereus)污染及其对食品安全的影响
《食品科学》2007, Vol. 28, No. 03
蜡状芽孢杆菌(Bacillus cereus)污染及其对食品安全的影响
周帼萍1,2,袁志明1,*
(1.中国科学院武汉病毒研究所,湖北 武汉 430071;2.武汉工业学院生物与制药工程系,湖北 武汉 430023)
收稿日期:2006-02-28
*通讯
简介:周帼萍(1971-) ,女,副教授,博士研究生,主要从事食品微生物与发酵工程。
摘 要:蜡状芽孢杆菌是常见的食品污染菌,在工业化社会中正成为日益重要的食物病原菌。它能产生一种呕吐毒素和多种肠毒素,主要引发呕吐和腹泻型食物中毒。与蜡状芽孢杆菌同属的苏云金杆菌也能产生类似的肠毒素,近来发现它可能与食品中毒有关。我国应当加强对蜡状芽孢杆菌的监测和研究。
关键词:蜡状芽孢杆菌;苏云金杆菌;食物安全;食物中毒;毒素
Review on Bacillus cereus Contamination Effects on Food Safety
ZHOU Guo-ping1,2,YUAN Zhi-ming1,*
(1.Wuhan Institute of Virology, Chinese Academy of Sciences, Wuhan 430071, China;
2.Department of Bioengineering and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Abstracts :As a ubiquitous soil microorganism, Bacillus cereus has become one of the important food-borne pathogens in the industrial societies. This bacterium can produce one emetic toxin and several enterotoxins to cause two distinct types of foodborne illnesses: emetic syndrome and diarrheal illness. Importantly, an entomopathogenic bacterium B.thuringiensis can also produce some enterotoxins similar to B.cereus. I it was recently found to be probably involved in food poisoning. It is necessary to strengthen the research and supervision of B.cereus. for guaranteeing food safety.
Key words:Bacillus cereus;Bacillus thuringiensis;food safety;food poisoning;toxins
中图分类号:Q939.97 文献标识码:A 文章编号:1002-6630(2007)03-0357-05
蜡状芽孢杆菌(Bacillus cereus)是一种在自然界中广泛分布的好气、中温、产芽孢的杆菌,是食品和化妆品中常见的污染菌。它同昆虫病原菌苏云金杆菌( B.thuringiensis) ,人畜病原菌炭疽芽孢杆菌( B.anthracis)、蕈状芽孢杆菌(B.mycoides)、韦氏芽孢杆菌(B. weihenstephanensis)组成芽孢杆菌属蜡状芽孢杆菌组(B.cereus group),它们的形态特征、生理生化特征非常相似,并有着极高的D N A 同源性[ 1 ] 。
1 蜡状芽孢杆菌污染及其影响
因为蜡状芽孢杆菌广泛存在于土壤、空气、水和尘埃中,所以无法避免地会污染到食品中。几乎所有种类的食品都曾被报道与蜡状芽孢杆菌引发的食物中毒有关,主要有:乳品、米、蒸煮的米饭和炒饭、调料、干制品( 面粉、奶粉等) 、豆类和豆芽、肉制品、焙烤食品等。
除了个别案例外,由蜡状芽孢杆菌引起的食物中毒通常症状较温和而且不超过24h,而且各国并未要求报告零星发生的食物中毒,所以相当多的这类食物中毒事件并未经报道,导致其数量被大大低估了。目前只有北欧的少数国家公布了比较令人信服的数据:在挪威蜡状芽孢杆菌引发的食物中毒占食物中毒总数(病毒引起的除外)的33%(1988~1993),而在冰岛为47%(1985~1992),在芬兰为22%(1992),在荷兰是8.5%,在丹麦为5% (1990~1992),在法国为4%~5%(1998~2000)。其它国家以前曾报道的数量则远远低于此比例,例如英格兰和威尔士(0.7%),日本(0.8%),美国(1.3%) 以及加拿大(2.2%)[2-3]。最近在挪威和荷兰,通对蜡状芽孢杆菌进行有效的监控,已认定蜡状芽孢杆菌是食品中最常检出的病源微生物[4]。
蜡状芽孢杆菌是条件致病菌,偶尔能导致人的眼部感染,甚至是心内膜炎、脑膜炎和菌血症等疾病,但最常见的是导致两种不同类型的食物中毒:腹泻型和呕吐型。一般认为肠毒素在胃中会被破坏,所以腹泻型食物中毒是由残留下来的蜡状芽孢杆菌(芽孢或菌体)在小肠中生长、产肠毒素引起的,具体过程尚未完全明了。多数情况下,引起该类食物中毒的食品中蜡状芽孢杆菌的数量在105~108CFU/g,也有在数量较低的情况下(103~104CFU/g)导致食物中毒的。其症状类似于产气荚膜梭状芽孢杆菌(Clostridium perfringens)食物中毒:水样腹泻、腹部痉挛和疼痛,呕吐很少见。常因食用肉类、海鲜、乳品和蔬菜等食物引起,潜伏期一般为6~15h,一般持续24h;而致呕吐的毒素是该菌在食物中预先产生的,该毒素非常稳定,进入人体后在胃中与其受体5-HT3 结合,导致呕吐。所以尽管有时食物中检出的蜡状芽孢杆菌数量很低(102CFU/g),却仍能引发呕吐中毒。呕吐型食物中毒的潜伏期一般为0.5 ~6h,一般限于富含淀粉质的食品,特别是炒饭和米饭。主要症状为恶心、呕吐,有时有腹泻、头晕、发烧和四肢无力等症状,与金黄色葡萄球菌(Staphylococcusaureus)引发的食物中毒相似[3,5]。从目前的报道看,由蜡状芽孢杆菌引起的食物中毒在亚洲以呕吐型比较常见,而在欧洲和北美地区则以腹泻型更常见[ 6 ]。
引起这两种食物中毒的食品通常都是经过热加工处理的,但蜡状芽孢杆菌具有耐热的芽孢,往往能在食品加工如巴氏消毒以及烹饪后,残留下来,热处理诱发芽孢的萌发,在没有其它微生物与之竞争的条件下,大量生长繁殖,产生毒素并引起食品的腐败。近十年来在乳品工业中,发现一些耐低温的蜡状芽孢杆菌和韦氏芽孢杆菌能在冷藏温度下(6℃甚至更低)繁殖并产生肠毒素,导致食物中毒,这点引起了各国政府的关注[6-7]。目前美国、澳大利亚和欧盟几个成员国都在其国内法规和法令中对各类食品中的蜡状芽孢杆菌数量有所限定。
2 蜡状芽孢杆菌产生的毒素及其致病机制
2.1 呕吐型毒素
在蜡状芽孢杆菌产生的毒素中,呕吐毒素较危险,摄入30min 后就可能出现呕吐症状,曾经有一位瑞士17岁男孩因食用含大量呕吐毒素的食物引发急性肝衰和横纹肌溶解而死亡[8]。动物试验也证实它对肝脏有损害[9]。该毒素cereulide,1.2kD,是一种十二肽的热稳定性环状毒素,分子式为 (D-O-Leu-D-Ala-L-O-Val-L-Val)3[10-11]。其结构、性质和毒理与缬氨霉素很相似,是特异性的钾离子载体,能将K+转入线粒体内,破坏线粒体的氧化还原能力。但cereulide 的毒性更强,因为在K+ 的生理浓度下,cereulide 比缬氨霉素对K+ 的亲和力更强[12]。该毒素非常稳定,目前的各种食品加工方法,包括灭菌,均无法使其失活(能耐受126℃ 90min),而且还耐强酸(pH2.0)、耐蛋白酶水解[13]。
N. Agata等对多种食品中cereulide的产量进行了检测,发现对B.cereus NC7401 来说,在煮熟后的米饭中其产毒量很高,在富含淀粉质的食物中的产毒量也足以引起食物中毒;而在肉类、蛋品和密封的液体食品如牛奶和豆奶中虽可以检测到该毒素,但其含量较低。还发现在与醋、蛋黄酱及酱类一起煮的食物中,该菌株的生长和产毒都受到抑制,推测这可能是醋导致pH 降低的缘故[14]。在12~15℃时该毒素的产量却明显高于30℃时的产量,而且该毒素的产生与芽孢的产生没有相关性[13]。还有报道称该毒素只有在有氧条件下才能产生,所以缺氧条件如:充氮包装和真空包装能有效地防止该毒素的产生和积累[15]。
因为该毒素的分子量很小,无抗原性,这使其检测比较难,到目前为之尚缺乏一种快速可靠的检测方法。最常用是采用HEp-2 细胞进行细胞培养分析[16]。此外,该毒素会导致精子运动能力的下降,可以目测到,也可用电脑辅助的精子动力分析仪(CASA)分析样品对公猪精子的运动能力的抑制,进行定性和半定量检测[17-19]。近年来用分子生物学手段(PCR)检测产毒株的报道也较多[20-21],如P F Horwood 等人根据NRPS 基因的两个可变区的序列,针对产呕吐毒素的菌株设计了特异性的引物,进行PCR 以检测蜡状芽孢杆菌是否是产毒菌株,取得了良好的效果。该法灵敏度更高,而且检测速度更快。通过该试验也证实了该毒素的确是通过一种有模板指导的,非核糖体机制合成的,即由多酶复合体-非核糖体多肽合成酶(non-ribosomal peptide synthetases,NRPS)所合成[21]。
在呕吐食物中毒事件分离的蜡状芽孢杆菌均产cereulide 毒素,而且有着共同的独特表型特征,对其基因进行分析发现它们构成了一个高度同源的进化系[3,22]。
2.2 腹泻型毒素(肠毒素)
腹泻可能涉及到多个肠毒素基因的产物,目前至少已经发现了5 种不同的肠毒素,包括2 个三元毒素:溶血素BL(Hbl);非溶血性的肠毒素Nhe;3 个单一基因的产物:细胞毒素K(cytK)、肠毒素T(bceT)和肠毒素HlyII[23]。
Hbl 具有溶血性、细胞毒性和导致皮肤坏死及血管通透的活力,并会在兔肠段结扎试验中导致出现液体积聚现象,所以有人认为Hbl 是蜡状芽孢杆菌导致腹泻和眼内炎的主要毒力因子。它由结合亚基B(37kD)和两个溶血亚基L1(38.5kD)和 L2(43.5kD)组成。L1有细胞毒性,但3 种组分的共同参与可使肠毒素毒力达到最大。编码该毒素的3 个基因位于染色体上,是共转录的,组成了一个操纵子,有4 个不同的基因:hblC、hblD、hblA和hblB,如图1 所示,其中hblb 的功能未知[2]。有研究显示该基因在蜡状芽孢杆菌菌株中分布广泛而且其基因型和表型间有异质性[24]。
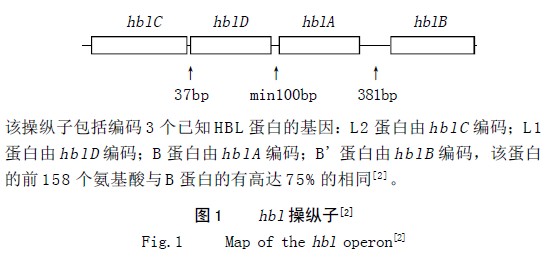 1995 年挪威爆发了一次大规模的食物中毒,其中一株蜡状芽孢杆菌的非溶血性的三元肠毒素(Nhe)的3 个组分被纯化出来。该毒素由45、39 和105kD 的蛋白组成[25]。Nhe 与Vero 细胞相互作用的研究表明105kD 蛋白是复合物的结合部位,而其它两个组分是无法单独结合到细胞上去。该1 0 5 k D 蛋白是一种金属蛋白,具有分解明胶和胶原的活力[26]。与hbl 基因不同,编码该毒素的基因位于质粒上[27]。1999 年Granum 等给出了nhe 操纵子的序列,该操纵子有3 个开放式阅读框与,相应的3 个基因分别是:nheA、nheB 和nheC。前两个基因的产物分别为上述的45kD 和39kD 蛋白,而nheC 的产物尚未纯化出来,其功能未知。有趣的是Nhe 和Hbl 蛋白之间在氨基酸序列上具有很高的相似性。这不仅体现在序列比较上,而且其预期二级结构如跨膜螺旋结构域上也是如此,尤其是NheA 与HblC 、NheB 与HblD 、NheC 与HblA[28]。
1995 年挪威爆发了一次大规模的食物中毒,其中一株蜡状芽孢杆菌的非溶血性的三元肠毒素(Nhe)的3 个组分被纯化出来。该毒素由45、39 和105kD 的蛋白组成[25]。Nhe 与Vero 细胞相互作用的研究表明105kD 蛋白是复合物的结合部位,而其它两个组分是无法单独结合到细胞上去。该1 0 5 k D 蛋白是一种金属蛋白,具有分解明胶和胶原的活力[26]。与hbl 基因不同,编码该毒素的基因位于质粒上[27]。1999 年Granum 等给出了nhe 操纵子的序列,该操纵子有3 个开放式阅读框与,相应的3 个基因分别是:nheA、nheB 和nheC。前两个基因的产物分别为上述的45kD 和39kD 蛋白,而nheC 的产物尚未纯化出来,其功能未知。有趣的是Nhe 和Hbl 蛋白之间在氨基酸序列上具有很高的相似性。这不仅体现在序列比较上,而且其预期二级结构如跨膜螺旋结构域上也是如此,尤其是NheA 与HblC 、NheB 与HblD 、NheC 与HblA[28]。
 具有细胞毒性的CytK 是从导致坏死性肠炎的菌株中分离的。其氨基酸序列显示它属于β- 桶孔形成毒素,能在磷脂双分子层中形成直径至少为7 A °的孔,该孔具有微弱的离子选择性,已证实它对人类肠道Caco-2 上皮细胞具有毒性[29]。
具有细胞毒性的CytK 是从导致坏死性肠炎的菌株中分离的。其氨基酸序列显示它属于β- 桶孔形成毒素,能在磷脂双分子层中形成直径至少为7 A °的孔,该孔具有微弱的离子选择性,已证实它对人类肠道Caco-2 上皮细胞具有毒性[29]。
Budarina 等人的实验室分离纯化了一种溶血素II(HlyII),分析其氨基酸序列发现它也属于β-桶孔形成毒素家族,许多芽孢杆菌群的细菌均含有该毒素,如:苏云金杆菌等。纯化后的HlyII 显示出对多种哺乳动物的红细胞有着不同程度的裂解毒性,据推测该毒素可能无需特殊受体就能与细胞膜结合[30-32]。
1995 年有人克隆了一个2.9kb 的DNA,命名为bceT,其产物为41kD 的毒素T ,并认为其有细胞毒性,属于肠毒素蛋白[33]。但是后来的研究证实了该毒素同Hbl 毒素无同源性,而且认为肠毒素T 不会导致食物中毒[34]。
3 蜡状芽孢杆菌与苏云金杆菌
蜡状芽孢杆菌和苏云金杆菌间的区别仅仅在于后者在芽胞形成时能产生位于芽孢孢外膜外的伴胞晶体,该性状由杀虫质粒编码。该质粒的丢失可使苏云金杆菌转化成蜡状芽孢杆菌,反之亦然[3,35]。基因组同源性分析也表明这两种细菌在DNA 水平上无明显的差别[1],甚至有学者建议应当将两者并入同一个种[36]。由于苏云金杆菌和蜡状芽孢杆菌间的高度同源性,苏云金杆菌安全性问题越来越受到人们的重视。1995 年就有报道称苏云金杆菌杀虫剂的生产菌株均能产生腹泻型肠毒素[35]。此后的许多研究也证实肠毒素基因在苏云金杆菌中是广泛存在的,而且是有表达活性的[37-38]。2000 年一项研究调查了24 个血清型的74 个苏云金杆菌菌株,包括各种商业化生产菌株,它们全部含nheBC,65 株含hblCD 和63株含有bceT 基因。除一株外,其它菌株的发酵液对Vero细胞表现出的毒力均与引起食物中毒的蜡状芽胞杆菌相当[39]。还有报道称来自食品[40]、并与食物中毒事件有关的部分蜡状芽孢杆菌经过仔细分析发现实际上是苏云金杆菌[41]。2005 年对一些即食食物进行调查发现:用传统方法检测的蜡状芽孢杆菌中有相当数量的(70%)菌株实际上是苏云金杆菌,而且某些菌株的表型及基因型特征与某商业化菌株相同,极可能是来自杀虫剂的污染[42]。这可能成为一个很严重的问题,因为苏云金杆菌生物杀虫剂已经在世界各国得到了非常广泛的应用。然而,常规蜡状芽孢杆菌的鉴定方法是无法区分这两种微生物的,可能有些食物中毒的爆发是由苏云金杆菌引起的,但未被鉴定出来。
4 结束语
我国目前还没有对由蜡状芽孢杆菌引起的食物中毒进行比较系统的调查、分析和统计,但是从我国的饮食结构、食品加工、保藏和运输条件来推测:蜡状芽孢杆菌的污染情况应当是比较严重的。随着乳品工业、快餐食品、婴儿食品、学生配餐和快餐业的迅速发展,蜡状芽孢杆菌尤其是耐低温菌株对这些食品的威胁是很大的,有可能导致大规模的食物中毒事件。特别是乳品行业,由蜡状芽孢杆菌引起的食物中毒极可能被误认为是乳糖不耐受症状而被忽视。因此从食品安全的角度来看,很有必要对我国食品中蜡状芽孢杆菌的检出率、分布情况和毒素基因的分布及毒素产生的情况进行调查,以查明污染源、污染途径,制订相应的检测标准和卫生安全标准,提供消毒和杀菌的指导,并为应对可能出现的突发食物中毒事件提供参考依据。
近年来,蜡状芽孢杆菌也被认为是一种有益的微生物,部分菌株开始用作益生素添加到食品和饲料中,还有作为植物生长促进剂使用的[3]。有必要对这些菌株的安全性进行系统的分析和评价。
随着人们环保意识的增强,生物农药的使用越来越普及,生物农药产业日益壮大。大量的苏云金杆菌的施用可能会导致对人体和食品安全的潜在威胁。尤其是蜡状芽孢杆菌和苏云金杆菌之间产毒质粒能进行水平转移,以及许多苏云金杆菌本身就携带肠毒素基因,要求我们对其安全性进行更深入、细致的评估。
参考文献:
[1] RASKO D A, ALTHERR M R, HAN C S, et al. Genomics of theBacillus cereus group of organisms[J]. FEMS Microbiology Review,2005, 29(2): 303-329.
[2] GRANUM P E, LUND T. Bacillus cereus and its food poisoning toxins[J]. FEMS Microbiology Letters, 1997, 157(2): 223-228.
[3] European Food Safety Authority. Opinion of the scientific panel onbiologicalhazardsonBacilluscereusandotherBacillussppinfoodstuffs[J]. The EFSA Journal, 2005, 175:1-48.
[4] BEATTIE S H, WILLIAMS A G. Detection of toxins[M]//Encyclopediaof food microbiology. London: Academic Press, 2000: 141-149.
[5] U.S. Food and Drug Administration. Bacillus cereus and other BacillusSPP[EB/OL]. http://www.cfsan.fda.gov/~mow/chap12.html.
[6] MCKILLIP J L. Prevalence and expression of enterotoxins in Bacilluscereus and other Bacillus spp, a literature review [J]. Antonie vanLeeuwenhoek, 2000, 77(4): 393-399.
[7] GRANUM P E, BRYNESTAD S, KRAMER J M. Analysis of enterotoxinproduction by Bacillus cereus from dairy products, food poisoningincidents and non-gastrointestinal infections [J]. Int J of FoodMicrobiology, 1993, 17(4): 269-279.
[8] SUBRAMANIAN S B, KAMAT A S, USSUF K K. et al. Virulent genebased DNA probe for the detection of pathogenic Bacillus cereus strainsfound in food [J]. Process Biochemistry, 2006, 41(4): 783-788.
[9] YOKOYAMA K, M ITO, AGATA N, et al. Pathological effect of syntheticcereulide,anemetictoxinof Bacilluscereus, isreversibleinmice[J]. FEMS Immunology and Medical Microbiology, 1999, 24(1): 115-120.
[10] AGATA N, OHTA M, MORI M, et al. A novel dodecadepsipeptide,cereulide, is an emetic toxin of Bacillus cereus[J]. FEMS MicrobiologyLetters, 1995,129(1):17-19.
[11] ISOBE M, ISHIKAWA T, SUWAN S, et al. Synthesis and activity ofcereulide, a cyclic dodecadepsipeptide ionophore as emetic toxin fromBacillus cereus[J]. Bioorganic & Medicinal Chemistry Letters, 1995, 5(23): 2855-2858.
[12] TEPLOVA V V, MIKKOLA R, TONSHIN A A, et al. The highertoxicityofcereuliderelativetovalinomycinisduetoitshigheraffinityfor potassium at physiological plasma concentration [J]. Toxicology andApplied Pharmacology, 2006, 210(1-2):39-46.
[13] FINLAY, W J, LOGAN N A, SUTHERLAND A D. Bacillus cereusproducesmostemetictoxinatlowertemperatures[J]. LettApplMicrobiol,2000, 31 (5): 385-389.
[14] AGATA N, OHTA M, YOKOYAMA K. Production of Bacillus cereusemetic toxin (cereulide) in various foods[J]. Int J of Food Microbiology,2002, 73(1):23-27.
[15] JAASKELAINEN E L, HAGGBLOM M M, ANDERSSON M A, et al.Atmospheric oxygen and other conditions affecting the production ofcereulide by Bacillus cereus in food[J]. Int J of Food Microbiology,2004, 96(1):75-83.
[16] FINLAY W J, LOGAN N A, SUTHERLAND A D. Semiautomatedmetabolic staining assay for Bacillus cereus emetic toxin [J]. ApplEnvironl Microbiology, 1999, 65(4):1811-1812.
[17] HOORNSTRA D, ANDERSSON M A. MIKKOLA R, et al. A newmethod for in vitro detection of microbially produced mitochondrialtoxins [J]. Toxicology in vitro, 2003, 17 (5-6): 745-751.
[18] RAJKOVIC A, UYTTENDAELE M, DELEY W, et al. Dynamics ofboar semen motility inhibition as a semi-quantitative measurement ofBacillus cereus emetic toxin (Cereulide) [J]. J of MicrobiologicalMethods, 2006, 65(3): 525-534.
[19] ANDERSSON M A, JAASKELAINEN E L. SHAHEEN R, et al.Sperm bioassay for rapid detection of cereulide-producing Bacilluscereus in food and related environments[J]. Int J of Food Microbiology,2004, 94(2):175-183.
[20] SCHULZ M E, FRICKER M, SCHERER S. Identification of emetictoxin producing Bacillus cereus strains by a novel molecular assay [J].FEMS Microbiology Letters, 2004, 232(2):189-195.
[21] HORWOOD P F, BURGESS G W, OAKEY H J. Evidence for nonribosomalpeptide synthetase production of cereulide (the emetic toxin)in Bacillus cereus[J]. FEMS Microbiology Letters, 2004, 236(2):319-324.21.
[22] SCHULZ M E, SVENSSON B, GUINEBRETIERE M H, et al. Emetictoxin formation of Bacilluscereus is restricted to a single evolutionarylineage of closely related strains [J]. Microbiology, 2005, 151(1): 183-197.
[23] HANSEN B M, HOIBY P E, JENSEN G B, et al. The Bacillus cereusbceT enterotoxin sequence reappraised [J]. FEMS Microbiology Letters,2003, 223(1): 21-24.
[24] THAENTHANEE S, WONG A C L, PANBANGRED W. Phenotypicand genotypic comparisons reveal a broad distribution and heterogeneityof hemolysin BL genes among Bacillus cereus isolates[J]. Int J of FoodMicrobiology, 2005, 105(2): 203-212.
[25] LUND T, GRANUM P E. Characterization of a non-haemolytic enterotoxincomplex from Bacillus cereus isolated after a foodborne outbreak[J]. FEMS Microbiol Lett, 1996, 141(2-3): 151–156.
[26] LUND T, GRANUM P E. The 105-kDa protein component of Bacilluscereus non-haemolytic enterotoxin (Nhe) is a metalloprotease withgelatinolyticandcollagenolyticactivity[J]. FEMSMicrobiologyLetters,1999,178(2): 355-361.
[27] KAMAT A S, NAIR C K K. Evidence for plasmid mediated toxin production in B.cereus BIS 59[J]. World J Microbiol Biotechnol, 1992(8): 210-211.
[28] GRANUM P E, SULLIVAN K O’, LUND T. The sequence of the nonhaemolyticenterotoxin operon from Bacillus cereus[J]. FEMS MicrobiolLett, 1999, 177(2): 225-229.
[29] HARDY S P, LUND T, GRANUM P E. CytK toxin of Bacillus cereusforms pores in planar lipid bilayers and is cytotoxic to intestinalepithelia[J]. FEMS Microbiology Letters, 2001, 197(1): 47-51.
[30] ANDREEVA Z I, NESTERENKO V F, YURKOV I S, et al. PurificationandcytotoxicpropertiesofBacilluscereus hemolysinII[J]. ProteinExpression and Purification, 2006, 47(1): 186-193.
[31] SINEV M A, BUARINA Z, GAVRILENKO I V, et al. Evidence of theexistence of hemolysin II from Bacillus cereus: cloning the geneticdeterminant of hemolysin II[J]. Mol Biol, 1993, 27: 1218-1229.
[32] BUDARINA Z I, SINEV M A, MAYOROV S G, et al. Hemolysin II ismore characteristic of Bacillus thuringiensis than Bacillus cereus[J].Arch. Microbiol, 1994, 161: 252-257.
[33] AGATA N, OHTA M, Y ARAKAWA, et al. The bceT gene of Bacilluscereus encodes an enterotoxin protein[J]. Microbiology, 1995, 141:983-988.
[34] CHOMA C, GRANUM P E. The enterotoxin T (BcET) from Bacilluscereus can probably not contribute to food poisoning[J]. FEMS MicrobiologyLetters, 2002, 217(1): 115-119.
[35] DAMGAARD P H. Diarrhoeal enterotoxin production by strains ofBacillusthuringiensis isolatedfromcommercial Bacillusthuringiensisbasedinsecticides[J]. FEMS Immunol Med Microbiol, 1995, 12(2-3):245-250.
[36] HELGASON E, OKSTAD O A, CAUGANT D A, et al. Bacillusanthracis, Bacillus cereus, and Bacillus thuringiensis—one species onthe basis of genetic evidence [J]. Appl Environ Microbiol, 2000, 66(6):2627-2630.
[37] PERANI M, BISHOP A H, VAID A. Prevalence of beta-exotoxin, diarrhoealtoxinandspecificdelta-endotoxininnaturalisolatesof Bacillusthuringiensis[J]. FEMS Microbiol Lett, 1998, 160(1):55-60.
[38] YUAN Z M, HANSEN B M, ANDRUP L, et al. Detection of enterotoxingenes in mosquito-larvicidal Bacillus species[J]. CurrentMicrobiology, 2002, 45(3): 221-225.
[39] RIVERA A M G, GRANUM P E, PRIEST F G. Common occurrence ofenterotoxin genes and enterotoxicity in Bacillusthuringiensis[J]. FEMSMicrobiology Letters, 2000, 190(1): 151-155.
[40] DAMGAARD P H, LARSEN H D, HANSEN B M, et al. Enterotoxinproducingstrains of Bacillusthuringiensis isolated from food [J]. LettAppl Microbiol, 1996, 23(3): 146-150.
[41] JACKSON S G, GOODBRAND R B, AHMED R, et al. Bacilluscereus and Bacillus thuringiensis isolated in a gastroenteritisoutbreak investigation[J]. Lett Appl Microbiol, 1995, 21(2):103-105.
[42] ROSENQUIST H, SMIDT L, ANDERSEN S R, et al. Occurrence andsignificanceof Bacilluscereus and Bacillusthuringiensis inready-to-eat food[J]. FEMS Microbiology Letters, 2005, 250(1):129-136.
2010-02-08 | 转基因水稻安全性评估,正在制造又一个“三聚氰胺”——质疑遗传改良国家重点实验室对安全性的评价
据瞭望周刊2月8日报道(http://news.sina.com.cn/c/sd/2010-02-08/155819653660.shtml), “作为转基因稻米的培育单位,华中农业大学作物遗传改良国家重点实验室(下称改良实验室)完全肯定转基因稻米的安全性。改良实验室在给本刊记者的回复中介绍道,“我校转基因水稻品系使用的是专一高效杀虫Bt蛋白。目前发现,只在水稻二化螟、三化螟和稻纵卷叶螟等鳞翅目害虫的肠壁上有这种蛋白质的结合位点,因而该蛋白能选择性地杀死该类害虫。而人类肠道上没有该蛋白质的结合位点,故不会对人类造成危害。人类认识Bt蛋白的来源生物苏云金芽杆菌已有100余年,安全使用Bt蛋白作生物杀虫剂有70多年,大规模种植和应用Bt作物已超过10年,目前没有过敏性反应的报告”,“实验室和田间试验分析结果表明,在生存能力竞争、基因漂移等方面,该品系对生态环境的影响是安全的”。回复称,有人担心长期食用转基因稻米的安全性,“小鼠灌胃实验”的结论可供参考讨论:该实验按照大鼠体重,每千克用5克抗虫BT蛋白每天两次灌食。8天后,各组动物体重和脏器重量无生物学意义上的差异。“华恢1号”稻米中抗虫蛋白含量≤2.5微克/克,要达到5克/千克(抗虫蛋白与体重的比率)的接受试验的剂量,体重60公斤的人需要吃120吨稻米。回复称,按照这个实验结果推理,如果按照每天吃500克稻米计算,一个成年人即使吃“华恢1号”转基因稻米657年也应该是安全的。关于这样的安全论证方式,回复表示:“这个推理可供大家讨论。”并向本刊记者介绍:“近年来,我们的科研人员长时间试吃了两个品系的大米,口感良好,而且健康状况良好。我们也愿意重申,一旦转基因水稻商业化生产后,我们科研人员的米缸里全是转基因水稻,到时候欢迎媒体监督!””
我作为一名科研人员,对这样的回答感到十分的震惊。我不明白,为什么我们的专家在讨论食品安全的情况时,会这样的不负责和不科学,这甚至让我再次怀疑,我们的农业科学家是否除了会发明(其实是“推广”美国的专利),三聚氰胺饲料以外,就没有别的能力了?只是用5g/kg的BT蛋白喂了8天大鼠,就认为安全,其实是很荒谬的。举一个三聚氰胺的例子吧。在1945年,的一个实验报道:将大剂量的三聚氰胺饲喂给大鼠、兔和狗后没有观察到明显的中毒现象。大鼠口服三聚氰胺的半数致死量大于3克/公斤体重。如果据此认可BT蛋白安全,那么三聚氰胺也是安全的,可以掺在大米里吃了。如果按照每公斤奶粉添加不超过2.5mg的三聚氰胺,人类每天吃500克奶粉,一个成年人即使吃三鹿奶粉400年,也不应该中毒,那么我们还制裁和查处三聚氰胺奶粉干什么呢?!可是,后来发现,动物长期摄入三聚氰胺会造成生殖、泌尿系统的损害,膀胱、肾部结石,并可进一步诱发膀胱癌。1994年国际化学品安全规划署和欧洲联盟委员会合编的《国际化学品安全手册》第三卷和国际化学品安全卡片也只说明:长期或反复大量摄入三聚氰胺可能对肾与膀胱产生影响,导致产生结石。2007 年美国宠物食品污染事件的初步调查结果认为:掺杂了≤6.6%三聚氰胺的小麦蛋白粉是宠物食品导致中毒的原因。从1945年到2007年,经过了整整52年,才证明了三聚氰胺的毒性。所以,我们如果不慎重,那么今天认可的BT蛋白,就可能是明天被后人唾骂的三聚氰胺了。所以,我们必须对自己和子孙负责。所以,这个所谓改良实验室认可BT蛋白,不过就是认可了又一个三聚氰胺罢了。所以,认可转基因作物的安全,必须要由专业的生物安全实验室来认可。
而且,作为一个科研人员,我们的改良试验科学家,竟然用卖大力丸的手段,现身说法地说:“近年来,我们的科研人员长时间试吃了两个品系的大米,口感良好,而且健康状况良好。我们也愿意重申,一旦转基因水稻商业化生产后,我们科研人员的米缸里全是转基因水稻,到时候欢迎媒体监督!”这根本就不是科学的态度。我甚至质疑,他们这样用人体进行试验,有没有通过伦理委员会的论证,是否得到过批准。而且,上次亨氏婴儿米粉转基因事件,是不是他们进行这种人体试验的一部分。有关部门应该对其进行立案调查。
还有就是,如我上一篇的博文中提到的,BT蛋白可以引起哺乳动物免疫器官损害和造血抑制,且可以与小鼠的肠道细胞结合。同时,BT蛋白可以引起哺乳动物产生IgG和IgE型的抗体,且可以引起皮肤试验中的I型超敏反应。这些铁的事实竟然被改良实验室的科学家否认了。所以,这样的改良实验室的食品安全试验结果是不公正的,片面的和不科学的。所以,至少从免疫学的角度讲,BT蛋白的安全性目前是不能肯定的,这也是欧美不用他们的主粮——小麦进行转基因的主要原因。希望我们的有关部门能重新考虑批准转基因水稻,以免出现不可挽回的后果。
北京大学免疫学系 王月丹 博士
于学院路38号
2010-02-02 | 希望农业部能重新考虑批准转基因大米——评“转基因水稻安全性遭质疑 袁隆平称不能预知危害”
http://immunohealth.blog.sohu.com/143740383.html
据中新网报道,“欧美科学家都不敢断定这项技术一定是安全的,中国科学家在如此短的时间内拿下安全证书似不稳妥” 。《国际先驱导报》记者金微发自北京 “中国成为国外转基因粮的生死试验场”“民族的噩梦”……已经两个月了,有关转基因水稻商业化种植的各种担忧仍然在网络上持续发酵,并逐渐蔓延形成一种恐慌。有的论坛还发起“反转基因主粮”的签名活动。2009年11月27日,农业部批准了两种转基因水稻、一种转基因玉米的安全证书,获得两个转基因水稻安全证书的是华中农业大学张启发教授及其同事。这是中国首次为转基因水稻颁发安全证书。在持续出现的质疑声中,转基因水稻安全证书的获得者——华中农业大学教授张启发一改低调,在1月6日宣布,“转基因水稻最迟5年内走上中国人的餐桌”。 农业部基因生物安全委员会三名委员近期做客人民网时,则批评媒体和公众的负面舆论,阻碍了转基因作物的商业化进程。他们宣传的转基因水稻的两个好处,一是减少农药用量,二是会增加产量。
对此,“我个人认为,政府应该特别慎重批准转基因植物商业化。科学家不能完全预知对生物进行转基因改造有可能导致何种突变,而对环境和人造成危害。虽然实验非常成熟,但其对人类可能造成的影响,或许要在未来几代人后才显现。”水稻专家袁隆平说。据中国人民大学农业与农村发展学院副院长郑风田透露,转委会里三分之二是转基因科学家。“里面的很多人是正在申请专利或申请通过者,环保和食品安全方面的成员非常少,这其中包含的利益是更让人担心的问题。”
对于这个事件,我也感到很严重,甚至可以说是十分担忧。由于上次,亨氏米粉转基因事件,我对BT蛋白转基因有了一些兴趣,并进行了文献研究(结果发表在《中国科技论文在线》这个网络平台上)。我简要说一下:
1)BT蛋白对于昆虫细胞的毒性可能并不特异。实验证明,BT蛋白不仅可以溶解昆虫动物的肠道细胞,而且可以溶解非昆虫细胞来源的磷脂双分子层,并且可以与哺乳动物的肠粘膜细胞发生结合。因此,在高浓度的时候,可能会对哺乳动物造成毒性。
2)BT蛋白在人体中能够蓄积,其长期毒性不能低估。虽然,BT蛋白对于小鼠的LD50为20g/KG,但其蓄积系数大于6.24,长期摄入可造成肝、肾细胞空泡化,肾血管上皮细胞变性,等肝肾功能损害。
3)BT蛋白抑制机体的免疫功能和造血功能。动物实验证明,长期大量摄入BT蛋白,可以造成机体红细胞减少和造血抑制,同时导致白细胞数量减少。动物实验还表明,摄入BT蛋白的小鼠,其脾脏和胸腺等免疫器官出现明显的萎缩,T细胞的增殖能力明显下降。
4)BT蛋白具有引起自身免疫性疾病的潜在危险。动物实验证实,BT蛋白能激发机体产生特异性的免疫应答,出现抗BT蛋白的抗体。这些抗体可能识别那些积蓄于自体细胞(如肾小球细胞)表面的BT蛋白,导致自身免疫性疾病,如溶血性贫血和肾脏炎症。同时,在体内存在的BT蛋白还可以与这些抗体形成循环的抗原-抗体复合物,导致肾炎或其它自身免疫性疾病(如红斑狼疮和类风湿性关节炎等等)。
5)BT蛋白可以引起超敏反应。研究证明,BT蛋白可以引起机体产生IgE型的特异性抗体,从而引发I型超敏反应,导致荨麻疹和哮喘发作等等。
以上都是别人的研究结果,对我来说,只是一个参考。为了探求真相,我也亲自做了实验。我从北京科技大学获得了BT蛋白,请我们实验室的一位老师制备了抗BT的特异性单抗。同时,在小鼠中,BT蛋白确实可以引起IgG和IgE型的特异性抗体应答,但没有检测到IgA。在皮肤实验中,BT蛋白还可以引起人体产生I型超敏反应。此外,BT蛋白在体外还可以抑制巨噬细胞的吞噬功能。由于种种原因,我没能继续实验和发表这些结果,而且有人也劝我,应该相信政府的执政能力,不会冒然推动BT转基因大米。所以,我相信政府的专家,我希望农业部能重新考虑对转基因大米的批准。至少,应该对其免疫的安全性进行重新评估,我愿意义务为他们打工,做这个研究。因为这也关系到我自己和我家人今后的食品安全。如果,农业部不能认真考虑这件事,我也愿意和袁隆平院士一道去阻止其上市。
北京大学免疫学系 王月丹 博士
于学院路38号
附文点击下载:转BT毒素蛋白基因作物食品对免疫系统及其功能潜在影响的研究进展
转BT毒素蛋白基因作物食品对免疫系统及其功能潜在影响的研究进展
初明 王月丹
1 北京大学医学部基础医学院 100083
摘要: 为克服虫灾对农作物的威胁,含转BT 毒素蛋白基因作物的食品进入了人类的生活。
转BT 基因的作物可以通过裂解昆虫的肠道上皮细胞而杀死昆虫。但是有研究表明,BT 蛋白不仅可以引起机体产生IgE 和IgG 等抗体应答和T 细胞应答,具有引起超敏反应的潜在可能,而且还可能造成免疫器官和免疫细胞发育障碍或免疫系统功能紊乱,这种对免疫系统及功能的潜在影响可能对某些人群或某些发育阶段的人群更加显著。所以,在评价转BT 基因食品安全时,需要从免疫系统及其整体功能的角度进行评估,而不应仅关注其引起超敏反应的可能。
关键词:转基因食品 免疫 超敏反应 苏云金杆菌
目前,虫害是世界农作物减产的重要原因,每年因虫害造成的减产高达全球农作物产值的20-30%。为解除虫害,人们大量使用化学农药,不仅污染环境,而且造成了化学毒剂在农作物的积蓄,严重威胁着人类的健康。苏云金杆菌(Bacillus thuringiensis,BT)是由日本科学家S Ishiwata于1901 年发现,并由德国科学家Berliner在1915 年命名的一种非常重要的昆虫病原菌,该菌可以导致昆虫肠道细胞溶解从而杀死昆虫[1]。根据营养细胞的鞭毛抗原的血清学反应及其它特性,苏云金芽孢杆菌可划分为40 个血清种和54 个血清型亚种[2]。到目前为止,已发现苏云金芽孢杆菌的伴孢晶体蛋白至少对脊椎动物中4 个门和节肢动物门中9 个目的有害生物有活性。1957 年,美国太平洋酵母公司生产出来第一种以BT为主要成分的商品化微生物制剂(Thuricide)。BT制剂作为一种对人体安全、低环境污染的微生物杀虫剂, 在害虫的防治中发挥了重要作用, 成为国内外开发应用最广泛的生物农药之一。
1987 年Hilder等首次报道研制成功转基因抗虫植物[3],1995 年前后转基因抗虫马铃薯、棉花和玉米先后进入商品化生产[4]。从此,转基因抗虫性作物不断出现并得到推广。截止2003年,转基因作物的全球种植面积估计为6770 万公顷,其中4970 万hm2为耐除草剂的大豆、玉米、欧洲油菜和棉花,转基因抗虫性作物的种植面积为1220 万公顷。在各类抗虫作物中以BT杀虫基因的应用最早而且最为广泛[5]。但是,在进行转BT基因作物种植和推广的问题上,有关专家纷纷对其安全性和局限性表示担心[6-9]。本文拟从免疫学的角度对转BT基因食物对免疫系统功能的潜在影响进行初步的分析。
一、 BT 毒素蛋白的杀虫机制
BT在芽孢形成时可产生具有杀虫活性的晶体蛋白质,被称为杀虫晶体蛋白(insecticidalcrystal protein,ICP)或δ-内毒素(δ-endotoxin)。晶体蛋白易溶于碱性溶液[10]或含有B2 巯基乙醇、DTT 等还原剂的偏碱性溶液中, 难溶于中性或偏酸性溶液。研究发现,杀虫晶体蛋白是由分子量约为130kDa 的多肽分子即前毒素蛋白(protoxin) 通过分子间二硫键和氢键聚合而成。自Schnepf 等首次从BT中克隆cry 基因[11],至今已有130 多种杀虫晶体蛋白基因被报道。1989 年,Hofte 和Whiteley 根据当时已报道的42 个杀虫晶体蛋白基因核苷酸序列相
似性和编码ICP 的杀虫谱提出了基于功能的分类系统,将其划归为4 个晶体蛋白基因家族(crystal protein genes),即cry 基因家族。cry Ⅰ基因编码的毒性蛋白约81-138 kD,对鳞翅目害虫有毒性;cry Ⅱ基因编码的毒性蛋白约71-110 kD ,对鳞翅目和双翅目害虫有毒性;cry Ⅲ基因编码的毒性蛋白约70~129 kD ,对鞘翅目害虫有毒性; cry Ⅳ编码的毒性蛋白约68~125 kD,对双翅目害虫有毒性[12,13]。晶体蛋白在昆虫消化道的碱性环境中,被特定的蛋白酶水解, 产生分子量约为40-70 kD 不等的活性毒素。活性毒素与昆虫中肠上皮细胞表面的特异受体发生结合,随后快速而不可逆地插入质膜。Cry 蛋白含有由多个疏水的和亲水亲脂的α2 螺旋组成的α2 螺旋束,数个毒素分子的螺旋一起插入磷脂双分子膜形成细胞膜穿孔,引起细胞膜非极性化,破坏细胞渗透平衡,使昆虫肠上皮细胞裂解[14-16]。在家蚕的研究中发现,BT毒素可以在数分钟内抑制肠道对葡萄糖的吸收,并迅速提高昆虫血淋巴中钾离子的浓度。继而BT在昆虫的血淋巴中迅速增殖引起昆虫的败血症,导致昆虫死亡。研究表明,在碱性条件下,BT蛋白更易裂解产生小分子的活性多肽而增加毒性,降低pH值可以导致BT蛋白的溶解性下降而抑制其激活。
二、 BT 毒素蛋白与机体的免疫应答和超敏反应
BT毒素蛋白为一种细菌蛋白,分子量达到130KDa,通过X2 光晶体衍射分析发现,其分子是由至少三个结构域组成的具有一定空间结构的蛋白质。其中,结构域Ⅰ由一个α2 螺旋束组成,可能与细胞膜穿孔有关;结构域Ⅱ由三组β2 折叠片层组成,可能参与了毒素与膜受体蛋白的识别和结合;位于毒素分子C2 端的结构域Ⅲ,能够防止昆虫肠道蛋白酶对毒性肽分子的进一步降解[17]。所以,从理论上推测,BT毒素蛋白对于人及其它哺乳动物具有良好的免疫原性。动物试验也证实,BT蛋白是一种有效的抗原分子。现已证实,不仅可以通过免疫家兔或小鼠获得特异性识别BT毒素蛋白的多克隆和单克隆抗体,用于BT蛋白含量的ELISA检测,而且不同途径(腹腔注射或消化道口服)接触BT蛋白还可以引起全身性和黏膜局部免疫应答[18-21]。这些特点表明,BT蛋白与其它外源性抗原的性质和引起机体免疫应答的规律是完全相同的。
因此,与自然界中存在的其它天然抗原性物质一样,BT蛋白也有可能引起机体的免疫应答并可能通过一定的途径,造成机体的免疫损伤,如炎症和超敏反应。研究表明,喷施BT毒素农药(含有Cry1Aa和Cry1Ab毒素)工人的体内产生了特异性抗BT蛋白的IgG和IgE抗体。其中,IgE是介导I型(速发型)超敏反应的重要抗体,IgG则可能参与II型及III型超敏反应的发生。同时,研究还发现,大量接触BT毒素农药的工人及通过皮肤接触BT毒素的豚鼠,均产生了皮肤刺激症状[22,23]。这些证据表明, BT毒素引起的免疫应答既包括B细胞及抗体为主参与和介导的体液免疫应答,也包括T细胞(Th1 和Th2)为主介导的细胞免疫应答。
所以,BT毒素蛋白存在引起人类发生超敏反应的潜在可能(即致敏原性)。目前,虽然还未见BT毒素蛋白引起超敏反应的病例的报道,且BT毒素与已知的致敏原无同源性,但是由于人类对于抗原性物质的超敏反应现象有明显的个体差异,且目前仅有198 种致敏原(食物致敏原30 种) 的氨基酸序列是已知的,所以如果转BT基因的食用作物一旦推广,其相关的超敏反应病例的出现只不过是一个时间问题。
三、 BT 毒素蛋白对机体免疫系统的影响
虽然BT蛋白是潜在的致敏原,但是由于个体差异和BT在自然界中的广泛分布,所以能够对BT毒素产生强烈甚至致命性超敏反应的个体比例并不高,甚至可能仅相当于对谷蛋白过敏的人群比例。所以,尽管在对转BT基因安全性进行评估时,有关专家对其致敏潜力十分关注,但是,也不应忽视BT蛋白在体内对免疫系统的直接作用。Vázquez-Padrón等证实在小鼠消化道内BT蛋白能与动物肠黏膜细胞表面蛋白结合[24]。研究还表明,BT毒素蛋白可以在不含昆虫特异性受体的人工双层脂膜上形成阳离子通道, 并能形成穿孔[25]。这些证据表明,BT毒素蛋白可能并非如以前认识的那样特异,高浓度的BT毒素可能对人及哺乳动物机体及功能发生影响。动物试验表明,当小鼠摄入的BT内外毒素蛋白达到10mg/kg和100mg/kg时,动物的脾脏指数、T细胞ANAE阳性率及巨噬细胞的吞噬功能均可见明显的抑制,随着摄入剂量的增加,抑制作用更加明显,且可与注射环磷酰胺的阳性对照组出现类似的抑制现象。在实验中,BT毒素对于大鼠和小鼠的半数致死量(LD50)分别大于15g/kg和20g/kg,但是BT毒素在体内的蓄积系数大于6.24,可以导致胃肠道、肝脏及肾脏损伤,其中肝脏和肾脏中可见细胞肿胀和空泡样变性,且可见肾小球血管上皮细胞变性,不能排除是由免疫原因造成的。长期大剂量使用,动物的白细胞总数和血红蛋白含量显著下降,提示BT蛋白具有较明显的免疫抑制毒性[23]。当然由于一些原因,这方面的数据十分缺乏,且多为内外毒素共同进行试验,因而有人怀疑BT外毒素可能通过抑制哺乳动物的核酸代谢导致其细胞损伤,而转BT基因作物一般只转入BT的内毒素基因,所以目前判断摄入转BT基因食物能否导致免疫系统及其功能的损伤与障碍还为时过早。但是,不能否认目前的动物研究结果提示我们在评估转BT基因食物安全性的时候,更应评价其对免疫系统整体的影响而并非只考虑其是否具有致敏原性,因为前者更具有普遍性和科学性,是推广转BT基因食物的关键问题。
四、 转BT 毒素基因食物的潜在免疫学危害及其应对措施
同时,尽管BT毒素蛋白一直被认为是特异性的杀虫蛋白,对人及其它脊椎动物无害,但是研究表明,通过基因改造,不仅可以改变BT毒素蛋白的靶生物和靶细胞范围,而且可以大幅度提高BT毒素蛋白在植物总蛋白中的含量。多种常见的细菌毒素如大肠杆菌素A(ColicinA) 、白喉毒素(Diphtheria)等和BT毒素蛋白的一级结构和作用机制虽然不同, 但它们都具共同的三维构象特征,并且如前所述,在没有特异性受体时,BT蛋白也表现出一定的造成生物膜穿孔的现象。同时,Perlak 等先后通过基因修饰和改造,分别在棉花和马铃薯等作物中,将BT蛋白表达的水平提高了数百倍,最高达到植物总蛋白的0.3%[26-28]。并且,我们在注意昆虫对转BT基因作物产生抗药性的同时,也要看到抗药昆虫对转BT基因作物的选择可以导致植物表达更多BT蛋白的可能性。人工干预和自然选择均可以对转BT基因的植物造成压力,从而扩展其特异性的靶细胞范围或提高其表达的BT蛋白水平,从而对人体造成潜在的免疫系统及其功能的损伤。例如,一个儿童每天的蛋白摄入量应达到2.5g/kg(婴幼儿更多),如果其中的50%来自转BT基因植物的蛋白(按总蛋白的0.3%计算),每天的BT蛋白摄入量将达到3.75mg/kg。如前所述,该BT蛋白的摄入量已经十分接近可以引起免疫系统发育和功能障碍的水平,并可以通过抑制白细胞生成,造成进一步的免疫系统功能损伤。
研究还发现,尽管没有致畸和致突变的现象,高剂量的BT蛋白对仔鼠的骨骼骨化有一定的延缓作用[23]。
由此可见,BT 毒素蛋白对机体的免疫系统及机体的免疫应答存在着潜在的威胁,而不仅是我们原来预计的超敏反应。所以,针对BT 毒素蛋白的潜在威胁,我们必须采取相应的应对策略。首先,BT 毒素蛋白无耐热性, 在65℃超过1h 或80℃超过20min , 就能失去活性,且不溶于水或有机溶剂如氯防、丙酮、乙醚等, 仅溶于碱性溶液,经三氯醋酸、氯化亚汞等处理引起蛋白质变性而失去活性,在酸性或中性环境中容易降解,因此使用BT 蛋白为主的生物农药是安全的,其在土壤中的残留仅为3ng,不会对人类的健康造成直接的威胁。但是,由于转BT 基因作物中的BT 蛋白不易去除,必须经过加工处理(如加热和进行酸处理),使其失活才能保证安全;其次,BT 毒素蛋白对于特殊人群,如需要蛋白量大且正在骨骼发
育的儿童及胃酸分泌不足的人群,可能造成免疫系统发育及功能严重障碍,所以应避免向这些人群提供含BT 毒素蛋白食物,由于转BT 蛋白基因作物的遗传物质可能污染其它作物,因此必须严格限制和控制转BT 基因作物的种植;最后,尽管目前还没有转BT 基因食物造成急性超敏反应的临床报道,但是加工转基因稻米的工人可以对其产生IgE 型抗体,且在豚鼠试验中,可见皮肤刺激症状。这些都提示BT 毒素蛋白可能引起超敏反应,因此在使用转BT 基因生物来源的制品(如转BT 基因棉花的衣物)时,要考虑引起超敏反应的可能,曾经有超敏反应病史的人群应该避免接触,所以对于这类产品也应该进行标识管理。
总之,转BT基因杀虫作物的出现可能对机体的免疫系统造成潜在的影响,由于转基因蛋白可能在食物中占有很大含量,人们在认识这种影响时,应该走出仅关心超敏反应的误区,而更要关注其对免疫系统的整体影响。而且,由于通常认为敏感的生育繁殖指标在微生物农药或转基因抗虫作物的检测中,远远没有免疫指标敏感和易于定量,因此,有专家早就呼吁增设有关的免疫监控指标进行试验和安全性评价[23]。从目前情况来看,在未能确定转BT基因食品安全的状态下,还是应该以使用和研发BT蛋白类的农药为主要方向,而不应在转基因的问题上过于冒进。
参考文献
[1]. McConnell E, Richards AG. The Production by Bacillus thuringiensis Berliner of a heat stablesubstance toxic for insects. Can Microbil, 1959, 5: 161—168.
[2]. Dai Jing Yuan, Yu Ling. Ⅹ Ⅹ - Ⅷ Annual Metting SIP Abstract. Montpellier,France:1994.33-36.
[3]. Hilder VA, Gatehouse AM, Sheerman SE, et al. A novel mechanism of insect resistanceengineered into tobacco. Nature, 1987, 300: 160-163.
[4]. Peferoen M. Progress and prospects for field use of Bt genes in crops. Trends inBiotechnology. 1997, 15:173-177.
[5]. James C. Preview: Global Status of Commercialized Transgenic Crops: 2003. ISAAA: Ithaca,2003, ISAAA Briefs No. 30.
[6]. Quist D, Chapela IH. Transgenic DNA introgressed into traditional maize landraces in Oaxaca,Mexico. Nature, 2001, 414: 541-543.
[7]. Kaiser J. Pests overwhelm Bt cotton crop. Science, 1996, 273:423.
[8]. Zangerl AR, Mckenna D, Wraight CL, et al. Effects of exposure to event 176 Bacillusthuringiensis corn pollen on monarch and black swollowtai caterpillars under fieldconditions. Proc Natl Acad Sci, 2001, 98: 11908-11912.
[9]. Saxena D, Florest S, Stozky G. Insecticidal toxin in root exudates from Bt corn. Nature,1999, 402-480.
[10]. Bulla LAJ , Kramer KJ , Cox DJ , et al. Purification and characterization of theentomocidal protoxin of Bacillus thuringiensis. J Biol Chem, 1981, 256: 3000-3004.
[11]. Schnepf HE, and Whiteley HR. Cloning and Expression of the Bacillus thuringiensisCrystal Protein Gene in Escherichia coli. Proc Natl Acad Sci, 1981, 78: 2893-2897.
[12]. Hofte H, Whiteley HR. Insecticidal crystal proteins of Bacillus thuringiensis.Microbiol Rev, 1989, 53: 242-255.
[13]. Koziel MG, Carozzi NB, Currier TC. Optimizing expression of transgenes with an emphasison post-transcriptional events. Biotech. Genetic Engineering Rev, 1993, 11: 171-228.
[14]. Knowles BH, Ellar DJ. Structurally related Bacillus thuringiensis delta-endotoxinsdisplay major differences in insecticidal activity in vivo and in vitro. J Cell Sci,1986 ,83 : 89-101.
[15]. VanRie J, McGaughey WH, Johnson DE. Mechanism of Insect Resistance to the Micro BialInsect Icid Bacillusthuringiensis. Science,1990, 247: 72-74.
[16]. Ratna K. Vadlamudi, Eric Weber, Inhae Ji, Tae H. Ji, and Lee A. Bulla, Jr. Cloning andExpression of a Receptor for an Insecticidal Toxin of Bacillus thuringiensis. J Biol Chem.,1995, 270:5490-5494.
[17]. Li JD, Carroll J, Ellar DJ. Crystal structure of insecticidal delta-endotoxin fromBacillus thuringiensis at 2.5 A resolution. Nature, 1991, 353:815-821.
[18]. Moreno-Fierros, L. Garc í a, N. Guti é rrez,R. L ó pez-Revilla, R.V á zquez-Padr ó n, RI.Intranasal, rectal and intraperitoneal immunization with protoxin Cry1Ac from Bacillusthuringiensis induces compartmentalized serum, intestinal, vaginal and pulmonary immuneresponses in Balb/c mice. Microbes Infect, 2000, 2: 885-90.
[19]. Vázquez-Padrón, R.I, Moreno-Fierros, L. Neri-Bazán, L, de la Riva, G.A & López-Revilla,R.. Bacillus thuringiensis Cry1Ac protoxin is a potent systemic and mucosal adjuvant. ScandJ Immunol, 1999, 49: 578-584.
[20]. Vázquez-Padrón, R.I Moreno-Fierros, L. Neri-Bazán, L, de la Riva, G.A & López-Revilla,R. Intragastric and intraperitoneal administration of Cry1Ac protoxin from Bacillusthuringiensis induces systemic and mucosal antibody responses in mice. Life Sciences, 1999,64: 1897-1912.
[21]. Vázquez-Padrón, R. I., Moreno-Fierros, L. Neri-Bazán. L. Martínez-Gil, A.F., de la Riva,G.A. & López-Revilla, R. Characterization of the mucosal and systemic immune responseinduced by Cry1Ac protein from Bacillus thuringiensis HD 73 in mice. Braz J Med Biol Res,2000, 33: 147-155.
[22]. Bernstein, IL, Bernstein, JA, Miller M, Tierzieva S, Bernstein DI, Lummus Z, SelgradeMK, Doerfler DL, Seligy VL. Immune responses in farm workers after exposure to Bacillusthuringiensis pesticides. Environ Health Perspect, 1999, 107: 575-582.
[23]. 宋瑞琨,李龙,徐以平。苏云金杆菌内外毒素混合杀虫剂的毒理学研究。同济医科大学学报。
1996,25:362-365.
[24]. Vázquez-Padrón, R. I., Gonzáles-Cabrera, J., García-Tovar, C. Neri-Bazán, L.,López-Revilla, R., Hernández, M., Moreno-Fierros, L. & de la Riva.G.A. Cry1Ac protoxinfrom Bacillus thuringiensis sp. kurstaki HD73 binds to surface proteins in the mouse smallintestine. Biochem Biophys Res Comms, 2000, 271: 54-58.
[25]. Schwartz JL , Potvin L , Chen XJ. Single-site mutations in the conservedalternating-arginine region affect ionic channels formed by CryIAa, a Bacillusthuringiensis toxin. Appl Environ Microbiol, 1997, 63: 3978-3984.
[26]. Perlak FJ, Fuchs RL, Dean DA, McPherson SL, Fischhoff DA. Modification of the codingsequence enhances plant expression of insect control protein genes. Proc Natl Acad SciUSA, 1991, 88: 3324-3328.
[27]. Perlak FJ, Deaton RW, Armstrong TA, Fuchs RL, Sims SR, Greenplate JT, Fischhoff DA.Insect resistant cotton plants. Biotechnology(NY), 1990, 8: 939-943.
[28]. Perlak FJ, Stone TB, Muskopf YM, Petersen LJ, Parker GB, McPherson SA, Wyman J, LoveS, Reed G, Biever D. Genetically improved potatoes: protection from damage by Coloradopotato beetles. Plant Mol Biol, 1993, 22: 313-321.
The progress in the potential effects of BT transgenic
protein food on the immune system
Chu Ming and Wang YueDan
Department of Immunology, School of Basic Medicine, Peking University
Abstract In order to prevent plants from insects, food with transgenic insecticidal crystalproteins of Bacillus thuringiensis come into human daily life. The BT transgenic plants may killinsects by BT toxins. Some reports showed that BT proteins could not only induce IgE and IgGproduction and T cell mediated immune responses in vivo, which may potentially evoke allergy,but also could cause dysfunction of immune system. This dysfunction of immune system may bemore obviously in certain populations, such as children and babies. Thus, the potential effects ofBT transgenic food on immune system rather than its potential allergenicity should be considered,when the safety of BT transgenic food is being evaluated.
Keywords:transgenic corps, immunity, Allergy, Bacillus thuringiensis
简介:初明,男,1984 年10 月出生。现为北京大学医学部基础医学专业八年制学生,目前从事基础免疫学研究工作。
相关文章
「 支持!」
您的打赏将用于网站日常运行与维护。
帮助我们办好网站,宣传红色文化!
欢迎扫描下方二维码,订阅网刊微信公众号


